Хімія
Увага! Фотографуйте письмові домашні завдання та надсилайте їх на мою пошту alla.chaichuk12@gmail.com ! Вказуйте прізвище та клас.
25.05.2020
Практична робота №6. Розв’язування експериментальних задач
Перегляньте відео.
https://www.youtube.com/watch?v=0Q2Pp8plixU
20.05.2020
Тема.Практичне значення та застосування солей.
Підготуйте повідомлення про практичне значення та застосування солей. Робота може бути у вигляді реферата, презентації або написана в зошиті.
18.05.2020
Увага! Стартує тест. Для виконання тестового завдання вам необхідно перейти за посиланням join.naurok.ua , ввести код доступу 553852 і пройти тест. Тест дійсний до 16.00. Потім проходження тесту стане неможливим. При реєстрації обов*язково вказуйте своє прізвище, ім*я та клас!
18.05.2020
Увага! Сьогодні відбудеться підсумкова контрольна робота з хімії для сьомих класів. Доступ до роботи буде відкритий з 13.00 до 16.00. Потім написати контрольну роботу буде неможливо. Код доступу з*явиться на сайті о 13.00. При реєстрації обов*язково вкажіть своє прізвище, ім*я та клас.
15.05.2020 Шановні учні 7-х класів, які не пройшли тест за 23.04.2020, у вас є можливість пройти його сьогодні до 16.00. Перейдіть за посиланням join.naurok.ua та введіть код доступу 546676.
14.05.2020
Тема. Хімічні властивості солей: взаємодія з металами, кислотами,лугами,солями.
Зробіть короткий конспект. Напишіть самостійно рівняння реакцій взаємодії цинк сульфату, плюмбум(ІІ) хлориду, ферум(ІІІ) нітрату з натрій гідроксидом.





Тема. Солі у природі. Класифікація і номенклатура солей. Фізичні властивості солей.
Запишіть конспект, перегляньте відео.





06.05.2020
Виконайте практичну роботу в зошиті.
Тема. Практична робота № 5 «Розв’язування експериментальних задач»
Мета: розвивати навички практичного використання знань про фізичні й хімічні властивості речовин різних класів неорганічних сполук;
Обладнання та реактиви: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, реактиви й устаткування за інструкцією до практичної роботи № 5.
Хід роботи
Завдання 1. Розпізнавання речовин
У 2х пронумерованих пробірках містяться розчини:
сульфатної кислоти
натрій гідроксиду
Визначте, який розчин міститься у кожній пробірці. Запишіть послідовність дій, спостереження,відповідь. Вкажіть, яку речовину потрібно використати. Яке забарвлення вона мала і яке одержала після додавання до досліджених зразків? Поясніть спостереження, вкажіть формули і клас сполук відповідно до № зразків.
Завдання 2. Здійснення перетворень.
Експериментально здійсніть перетворення:
Магній→магній-оксид→магній сульфат→магній гідроксид
Висновок.
Закінчіть речення.
Речовини, що належать до різних класів, можна розпізнати ________________________________________________
Добування і перетворення речовин можна здійснити, якщо________
__________________________________________________________
Реакції в розчинах відбуваються до кінця, якщо_________________
__________________________________________________________
04.05.2020
Тема. Використання лугів, запобіжні заходи під час роботи з лугами.
Перегляньте відео, пригадайте попередньо вивчені теми. В зошиті напишіть про використання лугів.
https://www.youtube.com/watch?v=ZQF5dlc39J0
29.04.2020
Тема. Хімічні властивості нерозчинних основ: розклад під час нагрівання,взаємодія з кислотами.
Законспектуйте подану інформацію. На основі отриманих знань зробіть порівняльну таблицю лугів та нерозчинних основ. В таблиці треба порівняти хімічні та фізичні властивості цих сполук.
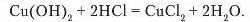
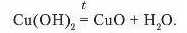
27.04.2020
Тема. Фізичні властивості основ.Хімічні властивості лугів:дія на індикатори. взаємодія з кислотами, кислотними оксидами. Реакція нейтралізації та її значення.
Напишіть конспект уроку та перегляньте відео за посиланням.
https://sites.google.com/site/distancijnevivcennahimiie/oksidi/osnovi
23.04.2020
Увага! Стартує тест. Для виконання тестового завдання вам необхідно перейти за посиланням join.naurok.ua , ввести код доступу 179013 і пройти тест. Тест дійсний до 27.04.2020 до 14.00. Потім проходження тесту стане неможливим. При реєстрації вказуйте своє прізвище та ім*я.
21.04.2020
Тема. Основи,їх класифікація за розчинністю у воді та кислотністю
Зробіть конспект уроку, перегляньте відео.
https://www.youtube.com/watch?v=qK_83nYlA3U
Тема.Кислотні дощі.
Перегляньте відео, використайте інформацію з нього для повідомлення про кислотні дощі.
https://www.youtube.com/watch?v=urJZkYxTeLY
13.04.2020
Тема.Хлоридна кислота,її властивості,добування,застосування.Кислоти в природі та побуті.Запобіжні заходи під час роботи з кислотами. Кислотні дощі.
Запишіть конспект уроку, виконайте завдання в пункті VІ.Узагальнення знань.
https://naurok.com.ua/urok-u-8-klasi-na-temu-hloridna-kislota-124510.html
Зробіть повідомлення в зошиті про кислотні дощі.
 НСl + Cu →
НСl + Cu →
09.04.2020
Тема. Фізичні та хімічні властивості кислот:дія на індикатори, взаємодія з оксидами металічних елементів, основами,солями.
Поняття про ряд активності металів. Взаємодія з металами різної активності
Запишіть конспект уроку. Допишіть рівняння хімічних реакцій в пункті V.Закріплення вивченого матеріалу.
https://naurok.com.ua/urok-himichni-vlastivosti-kislot-diya-na-indikatori-vzaemodiya-z-metalami-ryad-aktivnosti-metaliv-reakci-zamischennya-zahodi-bezpeki-pid-chas-roboti-z-kislotami-68516.html
07.04.2020
Тема. Класифікація кислот за складом,основністю. Номенклатура кислот.
Запишіть короткий конспект уроку.
https://subject.com.ua/lesson/chemistry/8klas/14.html
Наведіть приклади вмісту кислот в їжі.
_________________________________________________________________________________
17.03.2020
Тема. Розв"язування розрахункових задач.
Опрацювати §17-19 (Хімія 7 клас, Буринська Н.М.)
https://www.youtube.com/watch?v=gdbiZdPC3pE
https://www.youtube.com/watch?v=SGuydY9Qql8
19.03.2020
Тема. Значення води і розчинів у народному господарстві. Питна вода. Охорона водойм від забруднень.
Перегляньте відео. https://www.youtube.com/watch?v=M57Bg4WLVss
Наведіть приклади (письмово в зошиті):
У природі хімічні елементи існують у формі простих і складних речовин. Складні речовини поділяються на органічні та неорганічні. Класифікацію неорганічних речовин наведено на схемі 1.
Оксидами називають бінарні кисневмісні сполуки, в яких ступінь окиснення кисню дорівнює -2. В оксидах атоми кисню хімічно пов’язані з атомами інших елементів, але не утворюють зв’язків між собою. Усі атоми кисню в оксидах мають валентність, яка дорівнює ІІ. Оксиди утворюють практично всі елементи, тому клас оксидів досить численний і різноманітний за складом та властивостями.
Солетвірні оксиди у реакціях з кислотами або основами утворюють солі:
25.05.2020
Практична робота №6. Розв’язування експериментальних задач
Перегляньте відео.
https://www.youtube.com/watch?v=0Q2Pp8plixU
20.05.2020
Тема.Практичне значення та застосування солей.
Підготуйте повідомлення про практичне значення та застосування солей. Робота може бути у вигляді реферата, презентації або написана в зошиті.
18.05.2020
Увага! Стартує тест. Для виконання тестового завдання вам необхідно перейти за посиланням join.naurok.ua , ввести код доступу 553852 і пройти тест. Тест дійсний до 16.00. Потім проходження тесту стане неможливим. При реєстрації обов*язково вказуйте своє прізвище, ім*я та клас!
18.05.2020
Увага! Сьогодні відбудеться підсумкова контрольна робота з хімії для сьомих класів. Доступ до роботи буде відкритий з 13.00 до 16.00. Потім написати контрольну роботу буде неможливо. Код доступу з*явиться на сайті о 13.00. При реєстрації обов*язково вкажіть своє прізвище, ім*я та клас.
15.05.2020 Шановні учні 7-х класів, які не пройшли тест за 23.04.2020, у вас є можливість пройти його сьогодні до 16.00. Перейдіть за посиланням join.naurok.ua та введіть код доступу 546676.
14.05.2020
Тема. Хімічні властивості солей: взаємодія з металами, кислотами,лугами,солями.
Зробіть короткий конспект. Напишіть самостійно рівняння реакцій взаємодії цинк сульфату, плюмбум(ІІ) хлориду, ферум(ІІІ) нітрату з натрій гідроксидом.
1. Взаємодія розчинів солей із металами.
Працями М. Бекетова доведено, що метали проявляють різну хімічну активність. Тому в реакціях між металом і сіллю тільки активніший метал витіснить менш активний. Наприклад, якщо мідну монету покласти в розчин меркурій (II) нітрату, вона поступово покривається шаром ртуті, а мідь переходить в розчин:
Дослідимо взаємодію солей з металами у процесі лабораторного досліду.
Віртуальний лабораторний дослід 7
ВЗАЄМОДІЯ МЕТАЛІВ ІЗ СОЛЯМИ У ВОДНОМУ РОЗЧИНІ
Порівнявши активність металів, що вступають у реакцію, і тих, які входять до складу солей, можна зробити висновок: реакція відбувається тоді, коли метал є більш активним за той, що входить до складу солі.
Рівняння реакцій:
Fe + CuSO4 = FeSO4 + Cu ;
Zn + CuSO4 = ZnSO4 + Cu
Zn +SnCl2 = ZnCl2 + Sn;
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
2. Взаємодія солей з кислотами
Водні розчини солей реагують з кислотами, унаслідок чого утворюється нова сіль і нова кислота. Якщо до розчину нагрій
карбонату долити хлоридпої кислоти, то відбувається бурхливе виділення газу. Це свідчить проте, що реакція відбулася.
Однак не тільки карбонати взаємодіють з кислотами з виділенням газу. Під час доливання до розчину калій сульфіту нітратної кислоти теж спостерігається виділення газу. Це сульфур(ІУ) оксид.
Як вам відомо, реакції відоуваються, коли під час їх перебігу випадає осад. Візьмемо розчин барій хлориду й подіємо розчином сульфатної кислоти. Спостерігається випадання білого осаду.
BaCl2 + H2SO4 =BaSO4 + 2HCl
Вам уже відома реакція між аргентум нітратом і хлоридною кислотою. Під час цієї реакції випадає білий сирнистий осад.
AgNO3 + HCl = AgCl +HNO3
Отже, зробимо висновок про взаємодію розчинів солей з кислотами. Реакції між солями й кислотами в розчинах відбуваються за умови, якщо:
1) утворюється нова сіль і нова кислота. Нова кислота є нестійкою та розкладається на відповідний їй оксид і воду. У результаті реакції виділяється газ;
2) випадає нерозчинний у кислотах осад.
3. Взаємодія солей із лугами.
Na2SO4+ Ba(OH)2 = BaSO4+ 2NaOH.
Утворюється білий осад барій сульфату. Якщо до останнього долити кислоти, то осад не розчиняється.
Знову ж таки випав білий осад, який за доливання кислоти розчиняється.
4. Взаємодія розчинів солей між собою.
Розчинні у воді солі вступають у реакції обміну.
Рівняння реакцій:
AgNO3 + Na3PO4= Ag3PO4 + NaNO3
Зверніть увагу на те, що солі вступають у реакції обміну між собою тільки в розчинах.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Розчини солей взаємодіють з металами, якщо метал, що входить до складу солі, менш хімічно активний.
• Розчини солей реагують з кислотами. Реакції між солями й кислотами в розчинах відбуваються за таких умов:
1) виділяється газ:
2) випадає осад;
3) утворюється вода.
• Під час взаємодії розчинів солей з лугами утворюється нова сіль і нова основа.
• Розчини солей взаємодіють між собою. Реакції відбуваються до кінця, якщо один із продуктів реакції випадає в осад. Аргєнтум(І) нітрат є реактивом на хлоридну кислоту та її солі, а барій хлорид є реактивом на сульфатну кислоту та її солі.
12.05.2020Тема. Солі у природі. Класифікація і номенклатура солей. Фізичні властивості солей.
Запишіть конспект, перегляньте відео.
Кожного дня вдома для приготування їжі ми використовуємо кухонну сіль NaCl. Питну соду NaHCO3 здавна застосовували для миття посуду та приготування смачної випічки. У школі неможливо обійтись без крейди, основна складова якої кальцій карбонат CaCO3.
Усі ці сполуки належать до класу солей.
Солі — це складні речовини, що містять катіони металічних елементів та аніони кислотних залишків.
У формулах солей на першому місці пишуть символ металічного елемента, а потім кислотний залишок:
Таблиця 5
Кислотні залишки
Назви солей складаються:
• для елементів зі сталою валентністю:
• для елементів зі змінною валентністю:
наприклад: FeSO4 — ферум (ІІ) сульфат, CuCl2 — купрум (ІІ) хлорид.
наприклад: K2SO3 — калій сульфіт, CaCO3 — кальцій карбонат;
Формули солей складають аналогічно формулам оксидів, зрівнюючи заряди атомів металічного елемента й кислотного залишку.
Алгоритм складання формул солей
(на прикладі натрій ортофосфату та алюміній силікату)
Деякі солі, що широко використовуються в побуті, крім наукових, мають побутові (традиційні) назви. Наприклад, ви вже знаєте, що натрій хлорид NaCl називають кухонною або кам’яною сіллю, натрій карбонат Na2CO3 — це кальцинована сода, калій карбонат K2CO3 — поташ. Традиційні назви найбільш уживаних солей наведено в опорній схемі.
Поширення солей у природі
У природі солі є основною складовою більшості мінералів. Кухонна сіль — галіт; кальцій карбонат — мармур, вапняк, крейда; кальцій сульфат CaSO4 — гіпс та інші.
Солі відіграють важливу роль у процесах обміну речовин у живих організмах. Вони обов’язково присутні в м’язах, кістковій та нервовій тканинах. Наприклад, солі Калію відповідають за роботу серцевого м’яза. Натрію — за передавання нервового сигналу, завдяки чому організм сприймає інформацію ззовні та реагує на неї. Для росту кісток і зубів необхідні солі Кальцію.
Солі розчинені у клітинному сокові рослин. Недостатня кількість солей у ґрунтах знижує врожайність культур, тому сільське господарство використовує певні солі як мінеральні добрива.
Фізичні властивості солей
Солі — йонні сполуки. За звичайних умов це тверді речовини, з високими температурами плавлення та кипіння. Солі переважно безбарвні, або, як кажуть, білі. Це, наприклад, хлориди та сульфати Калію, Натрію,
Магнію, Цинку й інші. Деякі можуть бути забарвлені в різні кольори та відтінки: купрум(ІІ) сульфід CuS — чорний; нікель(ІІ) сульфат NiSO4 — зелений; кобальт(ІІ) сульфат CoSO4 — рожевий.
Розчинність є важливою характеристикою солей, вона дуже різноманітна. Є солі розчинні, малорозчинні та практично нерозчинні у воді. Наприклад, усі солі Натрію та Калію, а також усі нітрати добре розчинні. Серед силікатів, карбонатів, сульфітів, фосфатів і суль-
фідів переважна більшість солей — нерозчинні у воді, наприклад: FeSiO3, CrPO4.
Встановити розчинність солей у воді можна за Таблицею розчинності.
Таблиця розчинності основ, кислот, амфотерних гідроксидів і солей у воді за температури 20—25 0C
Смак не є фізичною властивістю, і кожен знає, що речовини на смак у лабораторії пробувати не можна. Відомо, що алхіміки, досліджуючи властивості речовин, випробували їх на смак. Інколи це закінчувалось трагічно. Все ж встановлено, що серед солей солоний смак мають лише кухонна сіль, калій хлорид і натрій сульфат, інші — гіркі або змішаних смаків. Солодкими на смак є солі Берилію та Плюмбуму, але ці солі отруйні.
06.05.2020
Виконайте практичну роботу в зошиті.
Тема. Практична робота № 5 «Розв’язування експериментальних задач»
Мета: розвивати навички практичного використання знань про фізичні й хімічні властивості речовин різних класів неорганічних сполук;
Обладнання та реактиви: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, реактиви й устаткування за інструкцією до практичної роботи № 5.
Хід роботи
Завдання 1. Розпізнавання речовин
У 2х пронумерованих пробірках містяться розчини:
сульфатної кислоти
натрій гідроксиду
Визначте, який розчин міститься у кожній пробірці. Запишіть послідовність дій, спостереження,відповідь. Вкажіть, яку речовину потрібно використати. Яке забарвлення вона мала і яке одержала після додавання до досліджених зразків? Поясніть спостереження, вкажіть формули і клас сполук відповідно до № зразків.
Завдання 2. Здійснення перетворень.
Експериментально здійсніть перетворення:
Магній→магній-оксид→магній сульфат→магній гідроксид
Висновок.
Закінчіть речення.
Речовини, що належать до різних класів, можна розпізнати ________________________________________________
Добування і перетворення речовин можна здійснити, якщо________
__________________________________________________________
Реакції в розчинах відбуваються до кінця, якщо_________________
__________________________________________________________
Тема. Використання лугів, запобіжні заходи під час роботи з лугами.
Перегляньте відео, пригадайте попередньо вивчені теми. В зошиті напишіть про використання лугів.
https://www.youtube.com/watch?v=ZQF5dlc39J0
29.04.2020
Тема. Хімічні властивості нерозчинних основ: розклад під час нагрівання,взаємодія з кислотами.
Законспектуйте подану інформацію. На основі отриманих знань зробіть порівняльну таблицю лугів та нерозчинних основ. В таблиці треба порівняти хімічні та фізичні властивості цих сполук.
Хімічні властивості нерозчинних основ.
1. Взаємодія нерозчинних основ із кислотами.
Віртуальний дослід. У нашому випадку можемо використати добуту нерозчинну основу куирум(ІІ) гідроксид або добути заново. Для цього до розчину купрум (ІІ) сульфату долиємо розчин иатрій гідроксиду.
До осаду добутої нерозчинної основи доллємо хлоридиу кислоту або сульфатну кислоту .Осад розчиняється й утворюється блакитний розчин солі купрум(ІІ) хлориду:
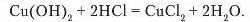
Продуктами реакції є, знову ж таки, сіль і вода.
Ураховуючи те, що реакція нейтралізації характерна для кислот і основ, варто зазначити: усі основи (розчинні та нерозчинні у йоді) взаємодіють із розчинами кислот, а всі кислоти (розчинні та нерозчинні) — лише з лугами.
Демонстрація досліду. https://www.youtube.com/watch?v=iiUm-Oba6QE
2. Розклад нерозчинних основ за нагрівання.
Дослідженнями доведено, що нерозчинні у воді основи за нагрівання легко розкладаються на відповідний оксид і воду. Це ще раз підтверджує, що ці сполуки є гідроксидами.
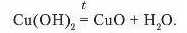
27.04.2020
Тема. Фізичні властивості основ.Хімічні властивості лугів:дія на індикатори. взаємодія з кислотами, кислотними оксидами. Реакція нейтралізації та її значення.
Напишіть конспект уроку та перегляньте відео за посиланням.
https://sites.google.com/site/distancijnevivcennahimiie/oksidi/osnovi
23.04.2020
Увага! Стартує тест. Для виконання тестового завдання вам необхідно перейти за посиланням join.naurok.ua , ввести код доступу 179013 і пройти тест. Тест дійсний до 27.04.2020 до 14.00. Потім проходження тесту стане неможливим. При реєстрації вказуйте своє прізвище та ім*я.
21.04.2020
Тема. Основи,їх класифікація за розчинністю у воді та кислотністю
Зробіть конспект уроку, перегляньте відео.
https://www.youtube.com/watch?v=qK_83nYlA3U
Основи - це складні речовини, що складаються із атомів металічного елемента та однієї чи кількох гідроксильних груп.
Класифікація основ
До розчинних основ належать
гідроксиди лужних металів (LiOH, NaOH, KOH, RbOH, CsOH);
гідроксиди лужно-земельних металів(Ca(OH)2, B
a(OH)2, Sr
(OH)2 ).
Всі інші основи - нерозчинні.
Однокислотні основи містять одну гідроксильну групу: NaOH, CuOH.
Двокислотні основи містять дві гідроксильні групи: Ca(OH)2, Cu(OH)2.
15.04.2020
Багатокислотні основи містять більше, ніж дві гідроксильні групи: Fe(OH)3.
Тема.Кислотні дощі.
Перегляньте відео, використайте інформацію з нього для повідомлення про кислотні дощі.
https://www.youtube.com/watch?v=urJZkYxTeLY
13.04.2020
Тема.Хлоридна кислота,її властивості,добування,застосування.Кислоти в природі та побуті.Запобіжні заходи під час роботи з кислотами. Кислотні дощі.
Запишіть конспект уроку, виконайте завдання в пункті VІ.Узагальнення знань.
https://naurok.com.ua/urok-u-8-klasi-na-temu-hloridna-kislota-124510.html
Зробіть повідомлення в зошиті про кислотні дощі.
Вивчення нового
матеріалу
Будова НСl
НСl – молекулярна формула
Н : Сl – електронна формула
Н – Сl – структурна формула
Фізичні властивості:
І. Хлороводню НСl: безбарвний газ, з різким запахом, добре розчинний у
воді, важчий за повітря, «димить» на вологому повітрі.
ІІ. Хлоридної кислоти НСl: безбарвна рідина, з різким запахом, добре розчинна у
воді, концентрована хлоридна кислота містить 37% НСl.
Хімічні властивості хлоридної
кислоти
НСl
ü безоксигенова кислота;
ü одноосновна;
ü слабкий окисник;
ü сильний електроліт.
1.
Дисоціює:
НСl ↔ Н+ + Сl –
лакмус – червоний;
метиловий оранжевий – рожевий.
2.
З основними та амфотерними оксидами:
2НСl + СuО → СuСl2 + Н2О
Al2O3 +
6HCl = 2AlCl3 + 3H2O
3.
З основами (реакція нейтралізації):
НСl + NaOH → NaCl + H2O
4.
З металами, що в ряді активності стоять до Н:
2НСl + Zn → ZnCl2 + H2
5.
З солями, якщо утворюється осад, газ чи малодисоційована
речовина:
Na2SiO3 +
2HCl = 2NaCl + H2SiO3↓
Добування хлороводню
І. У лабораторії хлороводень
добувають взаємодією кристалічного натрій хлориду з концентрованою сульфатною
кислотою при нагріванні:
t
2NaCl (крист.) + H2SO4 (конц.) = Na2SO4
+ 2HCl↑
За відсутності води хлороводень виділяється у вигляді газу, і реакція
перебігає до кінця. Якщо сульфатну кислоту взяти в надлишку і суміш несильно
нагрівати, то утвориться кисла сіль натрій гідрогенсульфат:
t
NaCl (крист.) + H2SO4 (конц.) = NaНSO4 +
HCl↑
надлишок
Збирають хлороводень витісненням повітря у суху посудину дном донизу.
ІІ. У промисловості хлороводень
добувають синтезом, тобто прямим сполученням хлору з воднем:
Н2 + Cl2 =
2НCl↑
Застосування НСl
1.
Добування
хлоридів.
2.
Протравлювання
металів при паянні (очищення від корозії).
3.
У харчовій
промисловості і медицині (НСl входить до складу шлункового соку).
VІ. Узагальнення знань
1.
Здійсніть
перетворення
Cl2 → HCl → NaCl → CuCl2
↓
NH4Cl
09.04.2020
Тема. Фізичні та хімічні властивості кислот:дія на індикатори, взаємодія з оксидами металічних елементів, основами,солями.
Поняття про ряд активності металів. Взаємодія з металами різної активності
Запишіть конспект уроку. Допишіть рівняння хімічних реакцій в пункті V.Закріплення вивченого матеріалу.
https://naurok.com.ua/urok-himichni-vlastivosti-kislot-diya-na-indikatori-vzaemodiya-z-metalami-ryad-aktivnosti-metaliv-reakci-zamischennya-zahodi-bezpeki-pid-chas-roboti-z-kislotami-68516.html
07.04.2020
Тема. Класифікація кислот за складом,основністю. Номенклатура кислот.
Запишіть короткий конспект уроку.
https://subject.com.ua/lesson/chemistry/8klas/14.html
Наведіть приклади вмісту кислот в їжі.
_________________________________________________________________________________
17.03.2020
Тема. Розв"язування розрахункових задач.
Опрацювати §17-19 (Хімія 7 клас, Буринська Н.М.)
https://www.youtube.com/watch?v=gdbiZdPC3pE
https://www.youtube.com/watch?v=SGuydY9Qql8
19.03.2020
Тема. Значення води і розчинів у народному господарстві. Питна вода. Охорона водойм від забруднень.
Перегляньте відео. https://www.youtube.com/watch?v=M57Bg4WLVss
Наведіть приклади (письмово в зошиті):
- Позитивного значення води в природі
- Негативного значення води в природі.
- Значення води у побуті.
- Значення води у народному господарстві.
23.03.2020
Тема. Класифікація, склад та номенклатура основних класів неорганічних сполук.
Оксиди в природі. Класифікація оксидів:основні, кислотні, амфотерні оксиди.
Зробіть схематичний конспект в зошиті.
С х е м а 1
ОксидиОксидами називають бінарні кисневмісні сполуки, в яких ступінь окиснення кисню дорівнює -2. В оксидах атоми кисню хімічно пов’язані з атомами інших елементів, але не утворюють зв’язків між собою. Усі атоми кисню в оксидах мають валентність, яка дорівнює ІІ. Оксиди утворюють практично всі елементи, тому клас оксидів досить численний і різноманітний за складом та властивостями.
Класифікація оксидів
Усі оксиди поділяють на солетвірні і несолетвірні (індиферентні) (схема 1).
Несолетвірні (індиферентні) оксиди не утворюють солей у реакціях з кислотами і основами. Таких оксидів 4: карбон (ІІ) оксид СО, силіцій (ІІ) оксид SiO, нітроген (І) оксид N2O, нітроген (ІI) оксид NO.Солетвірні оксиди у реакціях з кислотами або основами утворюють солі:
СаО + H2SO4 = CaSO4 + H2O; CO2 + 2NaOH = Na2CO3 + H2O.
Серед солетвірних виділяють основні, кислотні та амфотерні оксиди.
Хімічні властивості оксидів
1. Основні оксиди взаємодіють з кислотами і кислотними оксидами за звичайних умов та амфотерними оксидами і гідроксидами при сплавленні з утворенням солей:
MgO + H2SO4 = MgSO4 + H2O
CaO + N2O5 = Ca(NO3)2
2. Більшість основних оксидів безпосередньо з водою не взаємодіють. Лише оксиди лужних металів, кальцію, стронцію та барію взаємодіють з водою, утворюючи розчинні у воді основи - луги:
Na2O + Н2О = 2NaOH
ВаО + Н2О = Ва(ОН)2
3. Кислотні оксиди взаємодіють з основами та основними оксидами, з амфотерними оксидами та гідроксидами з утворенням відповідних солей:
SO3 + 2NaOH = Na2SO4 + Н2О
SO3 + ВаО = BaSO4
3SO3 + A12O3 = A12(SO4)3
3SO3 + 2A1(OH)3 = A12(SO4)3 + 3H2O
4. Багато кислотних оксидів безпосередньо взаємодіють з водою, утворюючи кислоти:
SO2 + Н2О = H2SO3
Р2О5 + 3Н2О = 2Н3РО4
5. Амфотерні оксиди одночасно проявляють властивості основних та кислотних оксидів. Амфотерні оксиди безпосередньо з водою не взаємодіють. Відносно кислот та кислотних оксидів амфотерні оксиди поводять себе подібно до основних:
А12О3 + 3H2SO4 = A12(SO4)3 + 3Н2О
А12О3 + 3SO3 = A12(SO4)3
6. Відносно основ та основних оксидів амфотерні оксиди поводять себе подібно до кислотних. При взаємодії з водними розчинами лугів або при сплавленні з оксидами та гідроксидами лужних та лужноземельних металів утворюють відповідні солі:
А12О3 + 6NaOH + 3Н2О = 2Na3[Al(OH)6]
А12О3 + 2NaOH = 2NaA1O2 + Н2О
25.03.2020
Тема. Фізичні та хімічні властивості оксидів:взаємодія з водою
https://www.youtube.com/watch?v=gze2MHvRaqI
1. Основні оксиди взаємодіють з кислотами і кислотними оксидами за звичайних умов та амфотерними оксидами і гідроксидами при сплавленні з утворенням солей:
MgO + H2SO4 = MgSO4 + H2O
CaO + N2O5 = Ca(NO3)2
2. Більшість основних оксидів безпосередньо з водою не взаємодіють. Лише оксиди лужних металів, кальцію, стронцію та барію взаємодіють з водою, утворюючи розчинні у воді основи - луги:
Na2O + Н2О = 2NaOH
ВаО + Н2О = Ва(ОН)2
3. Кислотні оксиди взаємодіють з основами та основними оксидами, з амфотерними оксидами та гідроксидами з утворенням відповідних солей:
SO3 + 2NaOH = Na2SO4 + Н2О
SO3 + ВаО = BaSO4
3SO3 + A12O3 = A12(SO4)3
3SO3 + 2A1(OH)3 = A12(SO4)3 + 3H2O
4. Багато кислотних оксидів безпосередньо взаємодіють з водою, утворюючи кислоти:
SO2 + Н2О = H2SO3
Р2О5 + 3Н2О = 2Н3РО4
5. Амфотерні оксиди одночасно проявляють властивості основних та кислотних оксидів. Амфотерні оксиди безпосередньо з водою не взаємодіють. Відносно кислот та кислотних оксидів амфотерні оксиди поводять себе подібно до основних:
А12О3 + 3H2SO4 = A12(SO4)3 + 3Н2О
А12О3 + 3SO3 = A12(SO4)3
6. Відносно основ та основних оксидів амфотерні оксиди поводять себе подібно до кислотних. При взаємодії з водними розчинами лугів або при сплавленні з оксидами та гідроксидами лужних та лужноземельних металів утворюють відповідні солі:
А12О3 + 6NaOH + 3Н2О = 2Na3[Al(OH)6]
А12О3 + 2NaOH = 2NaA1O2 + Н2О
25.03.2020
Тема. Фізичні та хімічні властивості оксидів:взаємодія з водою
https://www.youtube.com/watch?v=gze2MHvRaqI






А який код вид вчителя на контрольну роботу 18.05
ОтветитьУдалить